Erweiterte Mitochondrien-Diagnostik
Der BHI umfasst den funktionellen Zustand der Mitochondrien und dient der Früherkennung bioenergetischer Entgleisungen sowie der Beurteilung der mitochondrialen Funktion bzw. Dysfunktion bei einer Vielzahl von Beschwerden und Erkrankungen. Ein hoher BHI von mindestens 2,0 steht für funktionstüchtige Mitochondrien, während ein niedriger BHI funktionsuntüchtige Mitochondrien darstellt. Je geringer der BHI-Wert, desto größer ist der ATP-Mangel.
Was zeigt der BHI?
- er zeigt den Gesundheitsstatus der Mitochondrien
- er zeigt die Effizienz und Kapazität des Energiestoffwechsels
- er lokalisiert störende Einflussfaktoren in der Atmungskette
(oxidative & nitrosative Vorgänge) - er weist auf Sauerstoff (O2) verbrauchende Prozesse neben der Atmungskette hin
- er zeigt neue Ansätze für eine gezielte Therapie auf
Einflussfaktoren
Die Funktionsfähigkeit der Mitochondrien wird u.a. durch genetische und epigenetische Faktoren (Lebensstil, Ernährung, Bewegung, Psyche) beeinflusst, sowie durch das Alter, den aktuellen körperlichen Zustand, Entzündungen (Silent Inflammation), Immunkompetenz, Mikro- und Makronährstoffmangel, Stoffwechseldysregulationen und manifeste Krankheiten.
Funktioneller Zustand der Mitochondrien
Der BHI (Bioenergetic Health Index) umfasst mit den folgenden Parametern den funktionellen Zustand der Mitochondrien:
- Basalatmung
- ATP-Produktion
- Protonenleck
- Maximale Atmung
- Reserveatmungskapazität
- Nicht-mitochondriale Atmung
BHI-Multiparameteranalyse
Basalatmung
Die Basalatmung zeigt den Sauerstoffverbrauch an, der zur Aufrechterhaltung der Grundfunktionen notwendig ist. Ist die Nachfrage größer als das Energieangebot (z.B. durch Steigerung der körperlichen Aktivität), kann die Zelle auf die Reserveatmungskapazität der Mitochondrien zurückgreifen. Dadurch wird die Versorgung gewährleistet und eine ATP-Krise verhindert.
Protonenleck
Das Protonenleck ist das Maß für den Protonenfluss in der inneren Mitochondrienmembran, der nicht für die ATP-Synthese zur Verfügung steht. Ein Protonenleck vermindert daher die mitochondriale Leistungsfähigkeit in Bezug auf die ATP-Erzeugung. Ursachen können oxidativer Stresss (ROS) und/oder nitrosativer Stress (RNS) sein. Hierzu kann es dann notwendig sein folgende Parameter abzuklären: oxidativer Stress, niotrosativer Stress, Lipidperoxidation (PerOx), 8-OH-Desoxyguanosin (8OH-DG), Antioxidative Kapazität, Glutathion, SOD, Vitamin E, Selen, Zink u.a., Toxine, Schwermetalle.
Untersuchungen zeigten, dass bereits leichter oxidativer Stress die bioenergetischen Parameter modifiziert und zu einer Steigerung des Protonenlecks führt. [3]
Maximale Atmung/Sauerstoffverbrauch
Die maximale Sauerstoffverbrauchsrate ist die maximal mögliche Atmung, die die Mitochondrien durch die dem Zellmetabolismus bereitgestellten Substrate (Sauerstoff, Glukose, Glutamin, Aminosäuren, Fettsäuren, Mineralien, Vitamine u.a.m.) leisten können.
ATP-Produktion
Die ATP-Produktion ist das Maß für die Effektivität der Mitochondrien die energetische Nachfrage ausreichend zu befriedigen, wobei der Protonengradient für die ATP-Synthese genutzt wird. Ursächlich für eine verminderte ATP-Produktion ist ein erhöhtes Protonenleck. Der Wert sollte mindestens 91 % ausmachen.
Reserveatmungskapazität
Die Differenz des Sauerstoffverbrauchs bei basaler und maximaler Atmung wird als Reserveatmungskapazität bezeichnet. Sie zeigt an, inwieweit die Mitochondrien imstande sind, auf einen erhöhten Energiebedarf zu reagieren (z.B. Steigerung des Arbeitspensums, neuronale Aktivitäten).
Untersuchungen zeigten, dass oxidativer Stress zu einer fulminanten Reduzierung der bioenergetischen Reservekapazität führt. Eine geringe maximale Kapazität kann auf eine geringe Substratverfügbarkeit, eine geringe Mitochondrienmasse und eine beeinträchtigte Integrität der Mitochondrien hinweisen. [3]
Nicht-mitochondriale Atmung
Die nicht-mitochondriale Atmung bezieht sich auf sauerstoffverbrauchende Prozesse außerhalb der Mitochondrien, die vorwiegend von Enzymen abhängig ist und mit Entzündungen assoziiert sind. Eine hohe nicht-mitochondriale Atmung wirkt sich negativ auf die bioenergetische Gesundheit (BHI) aus.
Als Ursachen gelten proinmflammatorische Prozesse, die häufig ausgelöst werden durch Schwermetallbelastungen, intrazelluläre Erreger wie z.B. EBV, Borrelien, CMV, HSV, Chlamydien, Candida…, bakterielle Lipopolysaccharide (LPS) sowie chronische Entzündungen z.B. durch Leaky Gut, Autoimmunerkrankungen und Entgiftungsstörungen.
Untersuchungen zeigten, dass nicht-mitochondrialer Sauerstoffverbrauch in Gegenwart von Stressfaktoren, von reaktiven Sauerstoff- und Stickstoffverbindungen zunimmt. [3]
Ursachen Mitochondrialer Dysfunktion
- Mangel an Mitochondrien
- Fehlende Mitochondrienbildung
- Unzureichender Schutz vor ROS/RNS
- Gestörte Entgiftungsfunktion
ROS = Reaktive Sauerstoffspezies = Oxidativer Stress
RNS = Reaktive Nitrogenspezies = Nitrosativer Stress
Oxidativer Stress entsteht durch:
- Immunabwehr, Entzündungen, chronische Erkrankungen
- übermäßige körperliche Belastungen
- Luftverschmutzung, Feinstaub, Lösungsmittel, Ozonbelastung
- Medikamente, Alkohol, Nikotin, Schwermetalle
- Mycotoxine
Oxidativer Stress führt durch ein Übermaß an Freien Radikalen vor allem zu einer Abnahme der ATP-Bildung und einer Steigerung der Permeabilität (Durchlässigkeit) der inneren Mitochondrienmembran.
Nitrosativer Stress ensteht durch:
- Umweltgifte wie z.B. Pestizide, Schwermetalle, nitratreiche Nahrungsmittel
- Medikamente wie Langzeitnitrate, Antihypertonika, Antidiabetika, Antibiotika usw.
- chronische Entzündungen, chronischen Stress
- HWS-Traumen
Nitrosativer Stress führt durch erhöhtes Stickstoffmonoxid (NO) und Peroxinitrit zu Schädigungen an den Mitochondrien und einer Verminderung der ATP-Bildung.
Erkennung von Art & Ursachen mitochondrialer Dysfunktion
Die spezifische mitochondriale BHI-Diagnostik ist gegenüber den üblichen ATP-Messungen wesentlich differenzierter und daher deutlich überlegen. Mit der alleinigen intrazellulären ATP-Messung kann, unabhängig davon, ob eine Blockade durch Mitochondriengifte vorliegt oder nicht, in der Regel weder die Funktionalität der Zelle noch die mitochondriale Leistungsfähigkeit festgestellt werden.
Der BHI lässt Rückschlüsse auf Art und Ursachen einer mitochondrialen Dysfunktion zu, zeigt Ansätze für therapeutisches Vorgehen auf und erlaubt prognostische Aussagen über die Dauer erforderlicher Therapiemaßnahmen.
Ergänzende Biomarker
Alle genannten Ursachen lassen sich über die folgenden Biomarker erkennen und einer gezielten Therapie zuführen:
Verhältnis von mtDNA/nDNA
mtDNA = Mitochondriale-DNA
nDNA = nukleäre Kern-DNA in Eukaryontenzellen
Mitochondrien besitzen ein eigenes Genom. Eine zu geringe Anzahl an Mitochondrien pro Zelle lässt sich über das Verhältnis von mitochondrialer DNA zu nukleärer DNA erkennen. Daraus resultiert eine verminderte ATP-Produktion und eine niedrige maximale Atmungs- und Reservekapazität.
Mitochondrien haben leider ein sehr schlechtes DNA-Reparatursystem, so dass sie entsprechend anfällig für ROS/RNS-Prozesse sind (Oxidativer-/Nitrosativer Stress). Die Menge an Mitochondrien nimmt physiologisch mit zunehmendem Alter ab. Eine reduzierte mtDNA-Menge ist assoziiert mit diversen Erkrankungen wie z.B. chronischer Müdigkeit/CFS, metabolische Erkrankungen (z.B. Typ 2-Diabetes), neurodegenerativen Erkrankungen (z.B. M. Alzheimer, M. Parkinson), diverse andere chronische Krankheiten sowie erhöhte ATP-verbrauchende und mitochondrienschädigende Prozesse.
PGC-1a
PGC1a = Peroxisome Proliferator-Activated Receptor Gamma Coactivator-1Alpha.
Aus einem Mangel an PGC-1a ergeben sich Hinweise auf eine gestörte Neubildung von Mitochondrien. PGC-1a stellt einen wichtigen Cofaktor dar, der die mitochondriale Biogenese (Neubildung) anregt und für die Regulierung wichtiger ROS/RNS-entgiftender Enzyme mit verantwortlich ist. Außerdem schützt es u.a. vor neurodegenerativen Erkrankungen, Adipositas und Krebs.
NRF 2
NRF 2 = Nuclear factor erythroid 2-related factor 2
NRF2 stellt das wichtigste Schutzsystem der Mitochondrien gegenüber oxidativem oder nitrosativem Stress dar. Wird dies nicht ausreichend exprimiert, können ROS/RNS nicht neutralisiert werden, wodurch diese zunehmen und über eine Schädigung der inneren Mitochondrienmembran und mtDNA zu einer mitochondrialen Dysfunktion führen. Anzeichen für eine vermehrte ROS/RNS-Bildung ist ein erhöhtes Protonenleck.
Rhodanase
Dies ist der wichtigste Marker für die mitochondriale Detoxifikation (Entgiftung) von Schwefelwasserstoff und Cyanid. Schwefelwasserstoff fällt während der mitochondrialen aeroben Energiegewinnung (Atmungskette/Citratzyklus) physiologisch in bestimmten Konzentrationen an. Ein veränderter Sulfid-Stoffwechsel ist allerdings mit einer Reihe von Erkrankungen wie Alzheimer, Down-Syndrom und Colitis ulcerosa verbunden. In diesem Fall sind verstärkte Regulationsmechanismen notwendig, um den endogenen Sulfidspiegel zu kontrollieren.
Als Regulator fungiert die Rhodonase. Wenn diese Entgiftung gestört ist, droht eine Schädigung der Mitochondrien. Ein erhöhter Wert spricht für eine verstärkte mitochondriale Entgiftung.
Patientenbeispiele
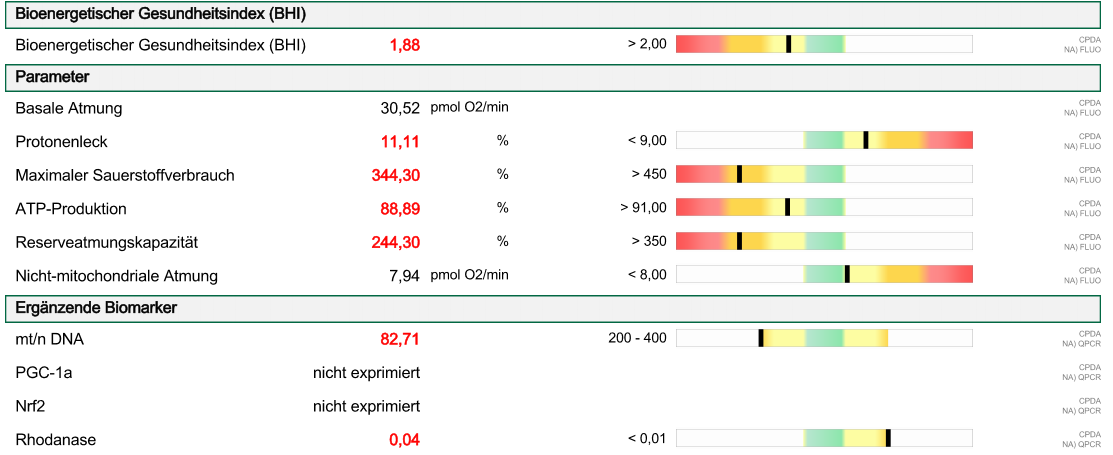
Patient, 44 J., Chronische Müdigkeit/CFS, Depression, Mitochondriale Dysfunktion, ATP-Mangel, Schimmelpilze, Dysbiose, Darmbakteriose, Exokrine Pankreas-Insuffizienz, HPU, Neurotransmitter- & Hormondysbalance
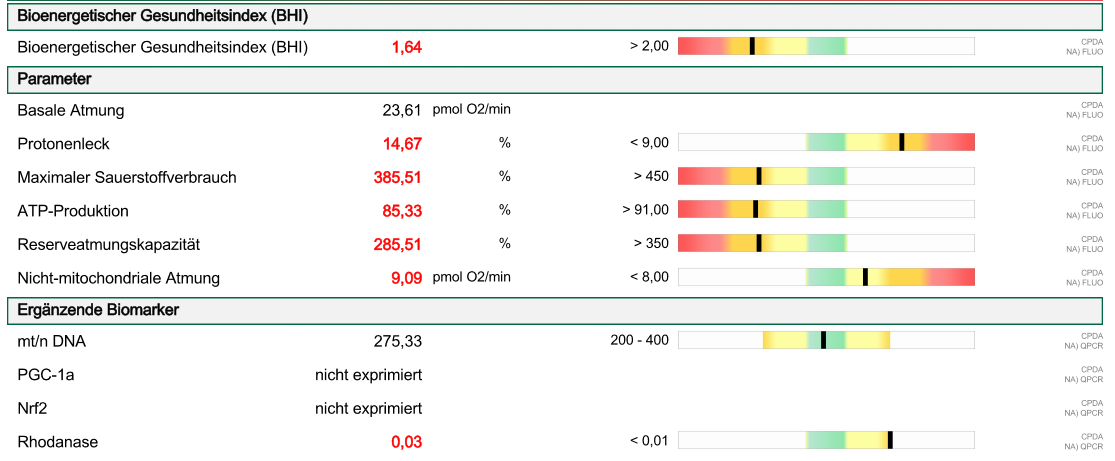
Patient, 65 J., Beruflicher Stress, TH1-, NK-, CD4-Immunzellschwäche, Mitochondriale Dysfunktion-, ATP-Mangel, HPU, Allergie, Nahrungsmittelunverträglichkeit, Dysbiose, Leaky Gut Syndrom, Histaminose
Patient, 71 J., Präventive Diagnostik
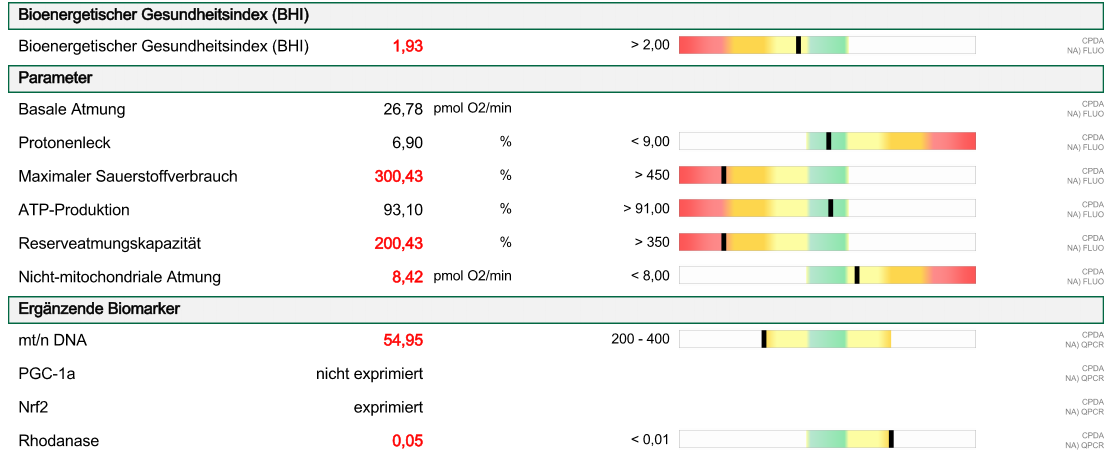
Praxisbefunde NHP W.P. Bales
Bei welchen Beschwerden & Krankheiten ist eine BHI-Analyse sinnvoll?
- Körperliche Erschöpfung, Abgeschlagenheit, Leistungsabfall, Antriebslosigkeit
- Burnout, CFS/ME, MCS, Depressionen, HPU
- Depressive Verstimmungen und Depressionen
- Neurologische und neurodegenerative Erkrankungen (M. Alzheimer/Demenz, M. Parkinson, MS, ALS)
- Immunschwächen, Autoimmunerkrankungen
- Metabolisches Syndrom, Adipositas, Typ 2-Diabetes/chron. Hyperglykämie
- Chronische Darmerkrankungen, Nahrungsmittelunverträglichkeiten
- Herz-Kreislauf-Erkrankungen, u.a. chronische Hypertonie
- Krebserkrankungen
- Alterserscheinungen z.B. Arteriosklerose
- Monitoring bei Sportlern
- Präventive Diagnostik
Quellen:
[1] Mitochondriale Medizin – BHI – Bioenergetischer Gesundheitsindex, Biovis Diagnostik MVZ, 2019
[2] Schütz, B., Kuenne, R., Steffen J.: BHI & weitere neue diagnostische Impulse für die mitochondriale Therapie, in: OM & Ernährung Nr. 170/2020
[3] König, B., Schütz, B., Enzmann, F.: Mitochondriale Medizin – Neue Wege in der Diagnostik mitochondrialer Dysfunktionen, Gesundheits Campus, biovis-Fortbildungsseminar 2020
[4] König, B.: Bioenergetik – der Goldstandard zur Beurteilung einer mitochondrialen Dysfunktion, in: OM & Ernährung Nr. 156/2016
[5] König., B.: Mitochondriale DNA – Welche Informationen stecken in Ihrer Sequenz? in: OM & Ernährung Nr. 164/2018
[6] König, B.: Bestimmung der genom-basierten mitochondrialen Heterogenität – ein zentrales Diagnostikum, in: OM & Ernährung Nr. 166/2019
Das könnte Sie auch interessieren:
ATP intrazellulär
Mitochondriale Aktivität
Mitochondrien-Medizin
Mitochondriale Diagnostik
Mitochondriale Regenerationstherapie

